
© MoneyToday 머크가 인정한 대장암 치료제…메드팩토 토종 혁신신약 성큼
메드팩토의 항암 치료제 신약 후보물질 '백토서팁'이 글로벌 제약회사 MSD(미국 법인명 머크)로부터 경쟁력을 인정 받았다. MSD의 면역항암제 '키트루다'와 병용요법으로 글로벌 임상 3상을 추진하기로 했다.
국내 제약 바이오 회사가 MSD와 공동 임상 3상 계약을 체결한 첫번째 사례다. 특히 대장암의 대부분(약 86%)을 차지하는 MSS(현미부수체 안정형)형 대장암 치료제의 임상 3상에 머크가 키트루다를 지원하는 세계 첫 사례이기도 하다.
키트루다는 MSS형 대장암에 효과가 없는 것으로 알려졌는데, 그만큼 백토서팁과 병용요법에 대한 MSD의 기대가 크단 의미다. 토종 대장암 치료제 혁신 신약이 등장할지 관심이 높아지고 있다.
17일 메드팩토에 따르면 MSD와 함께 2022년 상반기 한국과 미국 등 약 40개 기관에서 500~600명 환자를 대상으로 MSS형 대장암 치료제 글로벌 임상 3상에 진입할 계획이다.
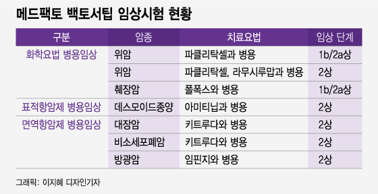
메드팩토는 2018년 MSD와 함께 백토서팁-키트루다 병용 임상을 시작했고 현재 2상을 진행 중이다. 2상이 완료되지 않은 시점에 MSD와 3상 계약을 체결한 점이 눈에 띈다. 진행 중인 2상 데이터가 긍정적으로 나왔다 추정할 수 있는 대목이다.
MSD와 체결한 임상 3상 계약이 갖는 의미는 적지 않다. 메드팩토는 임상 3상 과정에서 MSD로부터 키트루다를 무상 지원 받는다. 이를 통해 임상 3상 진행 비용의 약 35%를 절감할 수 있다. 키트루다를 임상 1상부터 3상까지 지원받은 국내 회사는 메드팩토가 유일하다.
전 세계적으로 키트루다와 관련한 1700건 이상의 임상 시험이 진행 중인데 MSD가 직접 3상을 지원하는 연구는 13건뿐이다. MSS형 대장암 치료제 임상 3상에 대한 키트루다 무상 지원은 처음이다.
메드팩토와 MSD는 MSS형 대장암 치료제 임상 3상 과정의 3분의 1 시점에 중간 평가를 하기로 했다. 중간 평가에서 성과를 확인할 경우 혁신치료제(Breakthrough Therapy) 지정과 조건부 허가(Accelerated Approval)를 신청해 조기 승인을 통한 기술이전 혹은 상업화에 나설 예정이다.
실제 임상 2상을 성공하고 3상에 진입한 약물은 신약 승인으로 이어질 가능성이 커진다. 미국바이오협회가 임상시험 모니터링 서비스 업체 바이오메드트래커(BioMedtracker)의 데이터를 분석한 결과, 2006년부터 2015년까지 임상 2상 성공률은 29%에 불과했다.
유효성 검증이 쉽지 않단 방증이다. 반면 임상 3상에 진입할 경우 신약승인신청(NDA)으로 이어질 확률이 55%로 상승한다.
MSD와 임상 3상 계약으로 백토서팁에 대한 시장 평가가 높아질 것으로 관측된다.
서근희 삼성증권 연구원은 "지난 6월 발표한 백토서팁-키트루다 병용 MSS형 대장암 환자 대상 임상 2상 데이터를 보면 경쟁사보다 항암 효과 및 안전성 측면에서 우수했다"며 "머크가 대장암 임상 3상 약물을 지원한 세계 첫 사례로 3상 중간 결과 확인 뒤 기술이전이 기대된다"고 분석했다.
이어 "코로나19(COVID-19)로 미뤄진 메드팩토의 여러 파이프라인에 대한 임상 데이터 발표가 2022년 잇따를 것"이라고 예상했다.
이동건, 원재희 신한금융투자 연구원은 "2022년 대장암 외 파이프라인의 개발 모멘텀에 주목할 필요가 있다"며 "임핀지 병용 비소세포폐암 2차 치료제 임상 2상 결과 공개, 췌장암 1b상 결과 공개 및 2상 개시, 데스모이드 종양 2상 개시 등으로 모멘텀이 부각될 전망"이라고 평가했다.
메드팩토 관계자는 "MSD와 글로벌 임상 3상 계약으로 임상적 유용성을 입증하는 등 매우 의미있는 성과를 냈다"며 "MSD와 글로벌 3상 계약을 필두로 내년엔 대장암뿐 아니라 데스모이드종양, 췌장암 등 연구에서 확실한 데이터를 기반으로 선택과 집중을 통해 백토서팁의 임상 속도에 박차를 가하겠다"고 말했다.








